Konfiguracja elektronowa odgrywa istotną rolę w zrozumieniu struktury atomu oraz jego chemicznych właściwości. Ujawnia sposób rozmieszczenia elektronów w atomie, omawiając jednocześnie strukturę powłok elektronowych i zasady kształtowania konfiguracji. Ważne jest również uwzględnienie wyjątków oraz ich zastosowań w chemii. Przykładem mogą być wodór i hel, które pokazują wpływ konfiguracji elektronowej na tworzenie wiązań chemicznych. Dzięki temu możemy lepiej zgłębić tę fascynującą dziedzinę nauki.
Spis treści
Co to jest konfiguracja elektronowa
Konfiguracja elektronowa pokazuje, jak rozmieszczone są elektrony w atomie danego pierwiastka. Jest to niezbędne do zrozumienia struktury elektronowej atomu i określenia jego właściwości chemicznych[1]. Elektrony rozmieszczone są na różnych poziomach energetycznych, co opisuje konfiguracja elektronowa.
Obliczenia kwantowomechaniczne pomagają ustalić tę konfigurację, szczególnie w przypadku pierwiastków o mniejszej liczbie elektronów. Zasady mechaniki kwantowej umożliwiają dokładne określenie, jak elektrony zajmują poziomy energetyczne i orbitale atomowe[1]. Konfiguracja elektronowa to nie tylko teoria; jest to również praktyczne narzędzie do przewidywania chemicznych reakcji atomów.
Jak rozmieszczone są elektrony w atomie
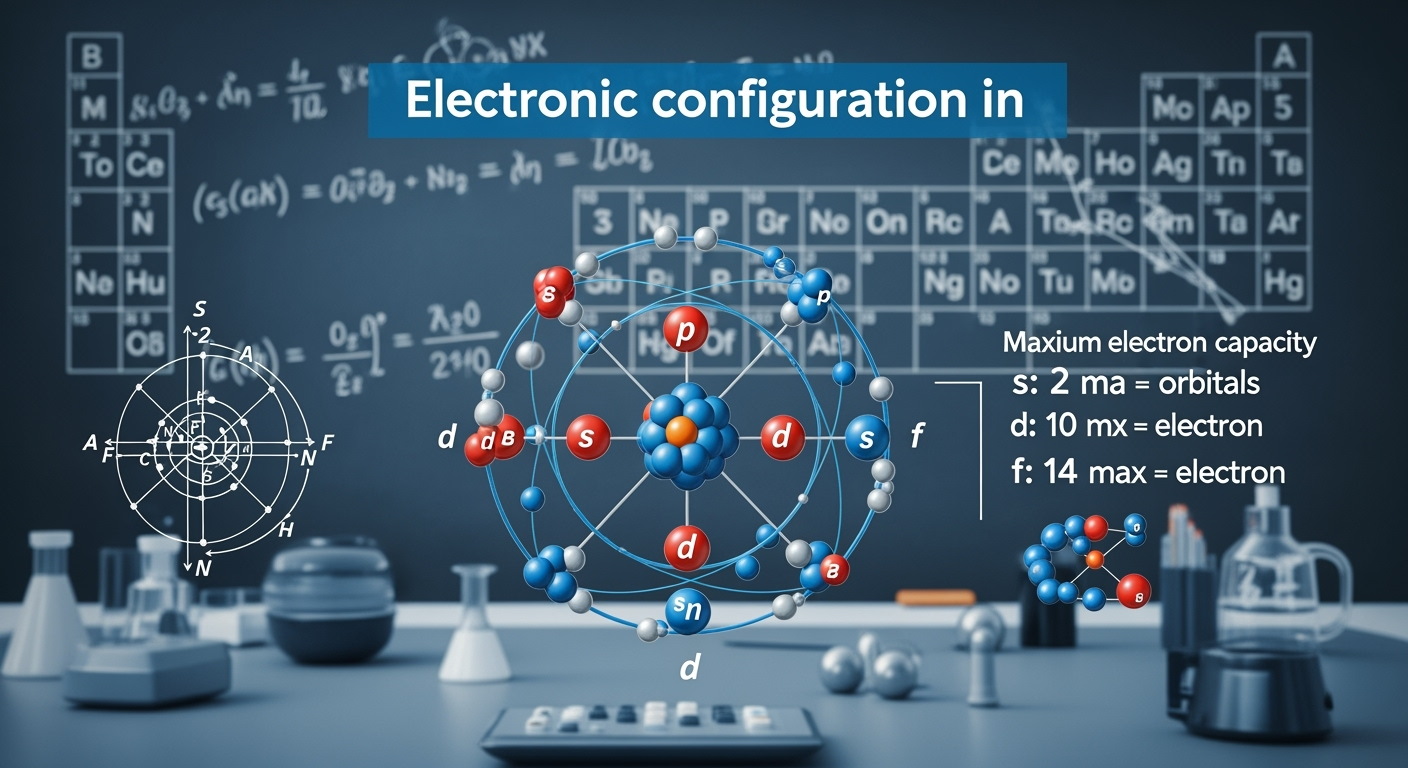
W atomie elektrony są rozmieszczone na poziomach energetycznych, zwanych powłokami elektronowymi, które z kolei dzielą się na podpowłoki zawierające orbitale: s, p, d i f. Zgodnie z zasadą minimalizacji energii, elektrony zaczynają od najniższych stanów energetycznych[2]. Najpierw wypełniają orbitale s, potem p, kolejne w kolejce są d, a na końcu f. Każdy z tych orbitalów ma swoją pojemność:
- orbital s może pomieścić 2 elektrony,
- p – 6,
- d – 10,
- f – aż 14.
Liczby kwantowe służą do opisu stanu energetycznego i rozmieszczenia elektronów w atomie.
Powłoki elektronowe i ich struktura
Elektrony rozmieszczają się w powłokach elektronowych, które składają się z różnych orbitali. Każda powłoka posiada swoją unikalną strukturę. Na przykład, powłoka K zawiera jeden orbital 1s, zdolny pomieścić 2 elektrony. Z kolei powłoka L obejmuje orbitale 2s i 2p, co łącznie daje miejsce na 8 elektronów (2 w orbitalu s oraz 6 w p). Powłoka M jest bardziej złożona, gdyż składa się z orbitali 3s, 3p i 3d, umożliwiając umieszczenie do 18 elektronów (2 w s, 6 w p i 10 w d).
Warto zauważyć, że każda z tych powłok ma coraz wyższy poziom energii, co sprawia, że elektrony najpierw wypełniają powłoki o niższej energii, zgodnie z zasadą minimalizacji energii[2].
Powłoka K – orbital 1s
Powłoka K, znana również jako orbital 1s, znajduje się najbliżej jądra atomowego i charakteryzuje się prostą budową. Składa się z jednego orbitalu, który jest w stanie pomieścić maksymalnie dwa elektrony. Z tego powodu pełni kluczową rolę w konfiguracji elektronowej najprostszych pierwiastków, takich jak wodór oraz hel. W kontekście chemii kwantowej elektrony w tej powłoce posiadają najniższą energię spośród wszystkich innych. To sprawia, że przy formowaniu konfiguracji elektronowych zapełniają się jako pierwsze.
Jak ustalić konfigurację elektronową
Aby ustalić konfigurację elektronową, należy zrozumieć zasady dotyczące zapełniania orbitali. W pierwszej kolejności trzeba określić, ile elektronów znajduje się w atomie danego pierwiastka, co jest możliwe dzięki znajomości jego numeru atomowego w układzie okresowym. Elektrony rozmieszczają się zgodnie z zasadą minimalizacji energii, czyli najpierw wypełniają orbitale o najniższej energii[1].
Zasady te obejmują między innymi regułę Hunda oraz zakaz Pauliego:
- reguła Hunda wskazuje, że elektrony zajmują oddzielne orbitale tej samej podpowłoki z równoległymi spinami, zanim zaczną się łączyć w pary,
- zakaz Pauliego stanowi, że w jednym orbitalu mogą znajdować się maksymalnie dwa elektrony, ale o przeciwnych spinach.
Kiedy wszystkie orbitale są wypełnione zgodnie z tymi zasadami, otrzymujemy pełną konfigurację elektronową. To pozwala na dokładne zrozumienie właściwości chemicznych pierwiastka. Aby lepiej prześledzić ten proces, warto przyjrzeć się przykładowym konfiguracjom prostych pierwiastków, takich jak wodór i hel.
Reguły zapełniania orbitali – s, p, d, f
Podstawowe reguły dotyczące wypełniania orbitali s, p, d, f są oparte na kilku istotnych zasadach. Przede wszystkim, orbitale są zapełniane zgodnie z rosnącym poziomem energii, co minimalizuje energię atomu. Do najważniejszych reguł należą zasada Hunda oraz zakaz Pauliego.
Zasada Hunda wskazuje, że elektrony najpierw zajmują oddzielne orbitale tej samej podpowłoki z równoległymi spinami, zanim zaczną się parować.
Natomiast zakaz Pauliego określa, że w jednym orbitalu mogą znajdować się maksymalnie dwa elektrony o przeciwnych spinach.
Orbitale s, p, d, f różnią się między sobą pojemnością:
- s może pomieścić 2 elektrony,
- p – 6,
- d – 10,
- f – 14.
Elektrony kolejno zapełniają orbitale w następującej kolejności: najpierw s, potem p, następnie d, a na końcu f. Te zasady umożliwiają przewidywanie rozmieszczenia elektronów w atomie, co jest kluczowe dla zrozumienia jego właściwości chemicznych.
Przykłady konfiguracji elektronowej dla wodoru i helu
Konfiguracja elektronowa wodoru to 1s¹, co wskazuje, że jego jedyny elektron znajduje się w orbitalu 1s, blisko jądra. W przypadku helu konfiguracja to 1s², co oznacza pełny orbital 1s z dwoma elektronami. Taki układ czyni hel chemicznie stabilnym, podobnie jak inne gazy szlachetne. Graficzne przedstawienie tych konfiguracji dla wodoru i helu ukazuje te proste, lecz istotne różnice w rozmieszczeniu elektronów w tych lekkich pierwiastkach.
Wyjątki i zmiany w konfiguracji elektronowej
Wyjątki w konfiguracji elektronowej występują, gdy elektrony przeskakują między orbitalami w celu zwiększenia stabilności atomu. Często mamy do czynienia z promocją elektronową, kiedy elektron z orbitalu s przemieszcza się na wyższy poziom energetyczny, jak choćby na orbital d. Takie zjawisko można zaobserwować na przykład w przypadku chromu i miedzi. Dla chromu konfiguracja elektronowa to: [Ar] 3d⁵ 4s¹, natomiast dla miedzi: [Ar] 3d¹⁰ 4s¹[5].
Zmiany te dotyczą również jonów. W kationach elektrony są usuwane z orbitalu o najwyższej energii, przeważnie z orbitalu s. Aniony natomiast przyjmują elektrony, które wypełniają najniżej dostępne poziomy energetyczne. Zrozumienie tych modyfikacji w konfiguracji elektronowej jest kluczowe dla poznania cech chemicznych i reaktywności pierwiastków.
Konfiguracja elektronowa dla kationów i anionów
Konfiguracja elektronowa jonów ulega zmianie w wyniku dodawania lub usuwania elektronów. Kiedy mówimy o kationach, czyli jonach o ładunku dodatnim, tracą one elektrony z orbitalu o najwyższej energii, jak z orbitalu s. Przykładowo, w przypadku Na⁺ konfiguracja zmienia się z [Ne] 3s¹ na [Ne]. Natomiast aniony, będące jonami ujemnymi, przyjmują dodatkowe elektrony, zazwyczaj do najniżej położonych energetycznie poziomów. Dla F⁻ konfiguracja przechodzi z [He] 2s² 2p⁵ do [He] 2s² 2p⁶. Zrozumienie tych modyfikacji w konfiguracjach elektronowych jest istotne dla analizy właściwości chemicznych i reaktywności pierwiastków[5].
Zastosowanie konfiguracji elektronowej
Konfiguracja elektronowa odgrywa istotną rolę w chemii, umożliwiając zrozumienie oraz przewidywanie właściwości pierwiastków[1]. Dzięki niej możemy lepiej analizować wiązania chemiczne, gdyż układ elektronów w atomach wpływa na ich zdolność do tworzenia związków.
Szczególne znaczenie ma konfiguracja walencyjna, czyli rozmieszczenie elektronów na najbardziej zewnętrznej powłoce[1]. To ona decyduje o reaktywności chemicznej pierwiastków. Przez analizę konfiguracji elektronowej można antycypować, jakie wiązania są możliwe między atomami, co jest niezwykle cenne przy syntezie nowych związków.
Dodatkowo, ta wiedza pogłębia nasze rozumienie mechanizmów reakcji chemicznych, co ma zastosowanie zarówno w badaniach laboratoryjnych, jak i w przemyśle. Jest to szczególnie istotne w takich dziedzinach jak farmacja, inżynieria materiałowa oraz nanotechnologia.
Znaczenie w wiązaniach chemicznych
Konfiguracja elektronowa odgrywa fundamentalną rolę w tworzeniu wiązań chemicznych. Elektrony walencyjne, znajdujące się na najbardziej zewnętrznej powłoce atomu, są kluczowe, ponieważ uczestniczą w reakcjach chemicznych, łącząc się z elektronami innych atomów. Dzięki temu powstają wiązania, takie jak jonowe czy kowalencyjne.
Konfiguracja walencyjna pokazuje, w jaki sposób atomy mogą się łączyć, co wpływa na formę i właściwości nowych związków chemicznych. Zrozumienie tej konfiguracji jest zatem niezbędne do przewidywania reaktywności pierwiastków i tworzenia innowacyjnych związków.
Źródła:
- [1] https://www.naukowiec.org/wiedza/chemia/konfiguracja-elektronowa-pierwiastka_3335.html
- [2] https://chemiazegzaminatorem.pl/konfiguracja-elektronowa/
- [3] https://knowunity.pl/knows/chemia-konfiguracja-elektronowa-atomw-3643a819-c7c9-4bd9-bb52-b3ed72cb230b
- [4] https://chemiamaturalna.com/konfiguracja-elektronowa/
- [5] https://zpe.gov.pl/a/przeczytaj/DRY7yzjbT

fizyk z pasji i zawodu, zafascynowany astrofizyką i mechaniką kwantową. Na co dzień pracuje na jednej z polskich uczelni, a w wolnych chwilach tropi naukowe ciekawostki i stara się tłumaczyć skomplikowane zjawiska w prostych słowach. W Klubie Naukowca dzieli się swoją wiedzą i entuzjazmem do odkrywania tajemnic wszechświata.