pH to istotny wskaźnik, który określa poziom kwasowości lub zasadowości substancji na skali od 0 do 14[1]. W tekście omówiono, w jaki sposób pH wpływa na absorpcję składników odżywczych i jego rolę w żywych organizmach. Dodatkowo, przedstawiono różne metody mierzenia i regulowania pH, w tym zastosowanie wskaźników, pH-metrów oraz kwasu azotowego.
Spis treści
Co oznacza pH i jak działa skala pH?
pH to skala mierząca, jak kwaśny lub zasadowy jest roztwór wodny, określająca jego chemiczne właściwości[2]. Wywodzi się z łacińskiego terminu potentia hydrogenii, co tłumaczy się jako potencjał wodoru. Zakres pH wynosi od 0 do 14 i jest obliczany jako ujemny logarytm dziesiętny stężenia jonów wodorowych (H⁺) w roztworze, wyrażony wzorem pH = − log [H⁺][3].
Roztwór o pH 7 jest uznawany za neutralny, co oznacza równowagę między jonami wodorowymi i hydroksylowymi[4]. Gdy pH spada poniżej 7, mamy do czynienia z roztworami kwaśnymi, gdzie dominują jony wodorowe. Z kolei wartości powyżej 7 wskazują na roztwory zasadowe, w których przeważają jony hydroksylowe.
Skala pH, wprowadzona przez Sørena Sørensena w 1909 roku, jest powszechnie używana do oceny kwasowości i zasadowości substancji w różnych dziedzinach nauki[5]. Odgrywa istotną rolę w procesach biologicznych i chemicznych, wpływając na takie aspekty jak rozpuszczalność i wchłanianie substancji chemicznych.
🫴 Zrozumienie skali pH jest niezbędne do analizy reakcji chemicznych, zarówno w środowisku naturalnym, jak i w organizmach żywych.
Dostarcza dokładnej miary aktywności jonów wodorowych, umożliwiając precyzyjną ocenę charakteru roztworu.
Definicja pH – miara kwasowości i zasadowości
pH to istotny wskaźnik chemiczny, który pozwala określić, czy roztwór wodny ma charakter kwaśny, czy zasadowy. Mierzy się go na podstawie stężenia jonów wodorowych (H⁺) w roztworze. Wyrażany jest jako ujemny logarytm dziesiętny tego stężenia, czyli pH = − log [H⁺].
Dzięki temu możemy zrozumieć, jakie właściwości chemiczne posiada dany roztwór:
- pH poniżej 7 sugeruje środowisko kwaśne,
- równe 7 oznacza neutralne,
- powyżej 7 wskazuje na zasadowe.
W praktyce pH odgrywa ważną rolę w dziedzinach takich jak chemia i biologia, wpływając na rozpuszczalność oraz wchłanianie różnych związków chemicznych[9].
Skala pH – zakres od 0 do 14
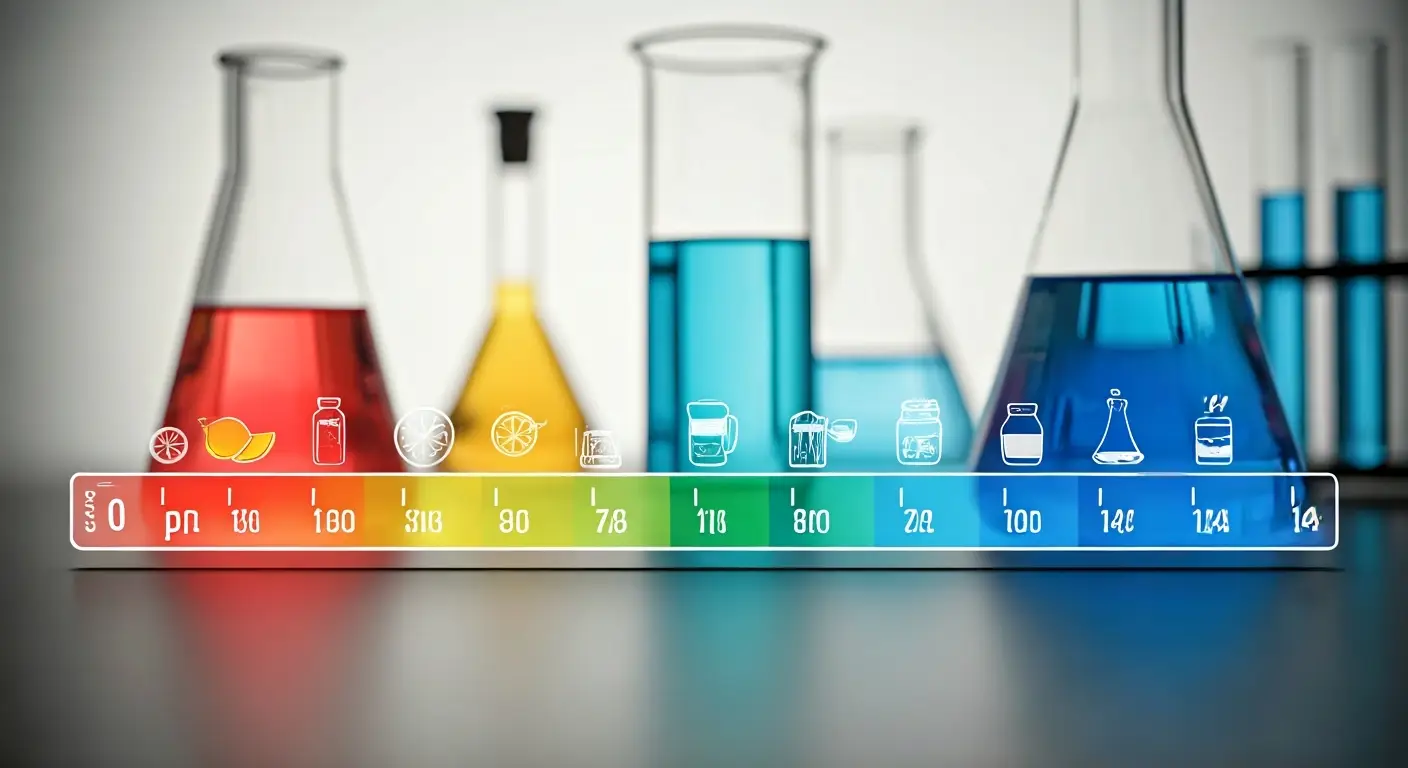
Skala pH obejmuje wartości od 0 do 14, gdzie pH 7 oznacza roztwór neutralny. Wartości poniżej tej liczby sygnalizują roztwory o charakterze kwaśnym, podczas gdy te powyżej 7 wskazują na zasady. Skala ta ma charakter logarytmiczny, co oznacza, że każdy kolejny stopień oznacza dziesięciokrotną zmianę stężenia jonów wodorowych.
W 1909 roku Søren Sørensen wprowadził tę koncepcję, co pozwoliło na precyzyjne określanie poziomu kwasowości i zasadowości roztworów wodnych. Skala pH jest powszechnie stosowana w dziedzinach chemii i biologii do badania właściwości chemicznych różnych substancji.
Jakie są znaczenie i wpływ pH na środowisko?
pH odgrywa kluczową rolę w środowisku, wpływając zarówno na procesy chemiczne, jak i biologiczne[6]. Oddziałuje na przyswajanie ważnych składników odżywczych, takich jak azotany i fosforany, niezbędnych do rozwoju roślin. Dodatkowo reguluje rozpuszczalność wielu związków chemicznych. Przykładowo, w kwaśnej glebie metale ciężkie stają się bardziej rozpuszczalne, co zwiększa ich toksyczność dla roślin oraz mikroorganizmów.
pH jest także istotne dla życia mikroorganizmów, wpływając na ich aktywność metaboliczną, co z kolei oddziałuje na cykle biogeochemiczne[7]. W ekosystemach wodnych, takich jak jeziora i rzeki, pH ma znaczenie dla bioróżnorodności oraz zdrowia publicznego. Zmiany wartości pH, spowodowane choćby kwaśnymi deszczami, mogą prowadzić do poważnych konsekwencji, jak ginięcie ryb.
Jeśli chodzi o materię organiczną, pH wpływa na tempo jej rozkładu. Neutralne lub lekko zasadowe środowisko sprzyja dekompozycji, co oddziałuje na cykle węglowe i azotowe. Zrozumienie wpływu pH na środowisko jest nieodzowne dla ochrony różnorodności biologicznej oraz stabilności ekosystemów.
Wpływ pH na absorpcję i rozpuszczalność składników pokarmowych
Poziom kwasowości, czyli pH, odgrywa istotną rolę w przyswajaniu i rozpuszczaniu składników pokarmowych w organizmach. Na przykład, gdy gleba ma niskie pH, metale ciężkie stają się bardziej rozpuszczalne, co może prowadzić do toksyczności. Natomiast zbyt wysokie pH ogranicza dostępność takich pierwiastków jak fosfor i żelazo, co utrudnia ich wchłanianie przez rośliny.
Dla większości roślin optymalny zakres pH mieści się między 5,5 a 6,5, gdyż w tym przedziale składniki odżywcze są najbardziej dostępne.
🫴 Zrozumienie wpływu pH na absorpcję jest kluczowe dla zdrowia zarówno roślin, jak i mikroorganizmów, ponieważ decyduje o możliwości przyswajania niezbędnych substancji odżywczych.
Rola pH w życiu i rozpadzie materii organicznej
pH odgrywa kluczową rolę w życiu oraz w rozkładzie materii organicznej. To, jaką wartość przyjmuje, wpływa na mikroorganizmy odpowiedzialne za ten proces. W środowisku neutralnym bądź lekko zasadowym mikroorganizmy działają efektywniej, co przyspiesza dekompozycję, a tym samym wpływa na cykle biogeochemiczne, takie jak cykl węglowy i azotowy.
W ekosystemach wodnych poziom pH oddziałuje na różnorodność biologiczną. Wiele organizmów zamieszkujących wodę jest wrażliwych na zmiany kwasowości, więc utrzymanie odpowiednich wartości pH jest niezbędne dla zdrowia publicznego oraz stabilności środowiska. Zbyt wysoka bądź zbyt niska kwasowość może prowadzić do toksyczności metali ciężkich, co ma szkodliwy wpływ na zdrowie zarówno roślin, jak i zwierząt.
Jak mierzyć i regulować pH?
Kontrola i regulacja poziomu pH odgrywa kluczową rolę w wielu dziedzinach, takich jak rolnictwo, chemia czy biologia. Istnieje kilka metod umożliwiających ocenę poziomu pH. Najprostszym sposobem jest wykorzystanie papierków wskaźnikowych, takich jak papierki lakmusowe, które poprzez zmianę barwy szybko informują o kwasowości lub zasadowości roztworu. Niemniej ich precyzja jest ograniczona.
Dla bardziej dokładnych wyników warto sięgnąć po pH-metry. Te urządzenia wykorzystują napięcie elektryczne generowane przez jony wodorowe w roztworze do pomiaru pH. Choć wymagają regularnej kalibracji dla zachowania dokładności, są niezastąpione w laboratoriach i przy złożonych analizach.
Regulacja pH ma również ogromne znaczenie, zwłaszcza w uprawach roślin[13]. Gdy pH gleby lub roztworu odbiega od normy, można je skorygować odpowiednimi chemikaliami. Na przykład, kwas azotowy jest często stosowany do obniżania pH przez zwiększenie stężenia jonów wodorowych, co skutkuje wzrostem kwasowości.
Dokładne mierzenie i regulowanie pH jest nieodzowne dla utrzymania optymalnych warunków w rozmaitych procesach chemicznych i biologicznych, wpływając tym samym na ich efektywność i bezpieczeństwo.
Metody pomiaru pH – wskaźniki i pH-metry
Różnorodne metody mogą posłużyć do mierzenia pH. Przykładem są papierki lakmusowe, które zmieniają barwę w zależności od kwasowości roztworu. Choć są one proste w użyciu, nie oferują najwyższej dokładności. W przypadku, gdy wymagane są precyzyjne wyniki, sięga się po pH-metry. Urządzenia te działają poprzez mierzenie napięcia elektrycznego generowanego przez jony wodorowe. Chociaż pH-metry muszą być regularnie kalibrowane, zapewniają poziom dokładności niezbędny w laboratoriach oraz w zaawansowanych badaniach chemicznych. Dodatkowo, w domowych warunkach można wykorzystać wywar z czerwonej kapusty jako prosty wskaźnik.
Korekta pH – zastosowanie kwasu azotowego
Korekta pH za pomocą kwasu azotowego to popularna technika stosowana w rolnictwie i ogrodnictwie w celu regulacji kwasowości ziemi lub podłoża. Kwas ten skutecznie obniża pH, zwiększając stężenie jonów wodorowych, co z kolei podnosi kwasowość. Dzięki temu można dostosować warunki do optymalnego wzrostu roślin, co jest szczególnie istotne, gdy pH gleby odbiega od preferowanego zakresu 5,5-6,5. Ważnym aspektem regulacji pH jest zapewnienie dostępności składników odżywczych, takich jak fosfor i żelazo, oraz minimalizacja toksyczności metali ciężkich.
Źródła:
- [1] https://www.ekologia.pl/slownik/ph/
- [2] https://www.dlaucznia.pl/lekcja/chemia,reakcje-chemiczne-w-roztworach-wodnych,odczyn-wodnych-roztworow-substancji-ph,ph-roztworu-obliczenia-chemiczne
- [3] https://e-naturalne.pl/pl/n/20
- [4] https://chemiamaturalna.com/obliczanie-ph-zasad/
- [5] https://epodreczniki.open.agh.edu.pl/handbook/29/module/582/reader
- [6] https://mojawoda.com/porady/121/co-to-jest-ph-kwasy-i-zasady
- [7] https://pl.khanacademy.org/science/high-school-biology/hs-biology-foundations/hs-ph-acids-and-bases/a/hs-ph-acids-and-bases-review
- [8] https://pl.khanacademy.org/science/ap-chemistry/acids-and-bases-ap/acids-bases-and-ph-ap/a/ph-poh-and-the-ph-scale
- [9] https://domowauprawa.pl/Czym-jest-pH-ccms-pol-35.html
- [10] https://chemiamaturalna.com/co-to-jest-ph-i-jak-je-obliczac/
- [11] https://www.youtube.com/watch?v=ddSs8dvRw8s
- [12] https://www.youtube.com/watch?v=IfOSs8PmATA
- [13] https://www.youtube.com/watch?v=lRksSS4lwbo

fizyk z pasji i zawodu, zafascynowany astrofizyką i mechaniką kwantową. Na co dzień pracuje na jednej z polskich uczelni, a w wolnych chwilach tropi naukowe ciekawostki i stara się tłumaczyć skomplikowane zjawiska w prostych słowach. W Klubie Naukowca dzieli się swoją wiedzą i entuzjazmem do odkrywania tajemnic wszechświata.